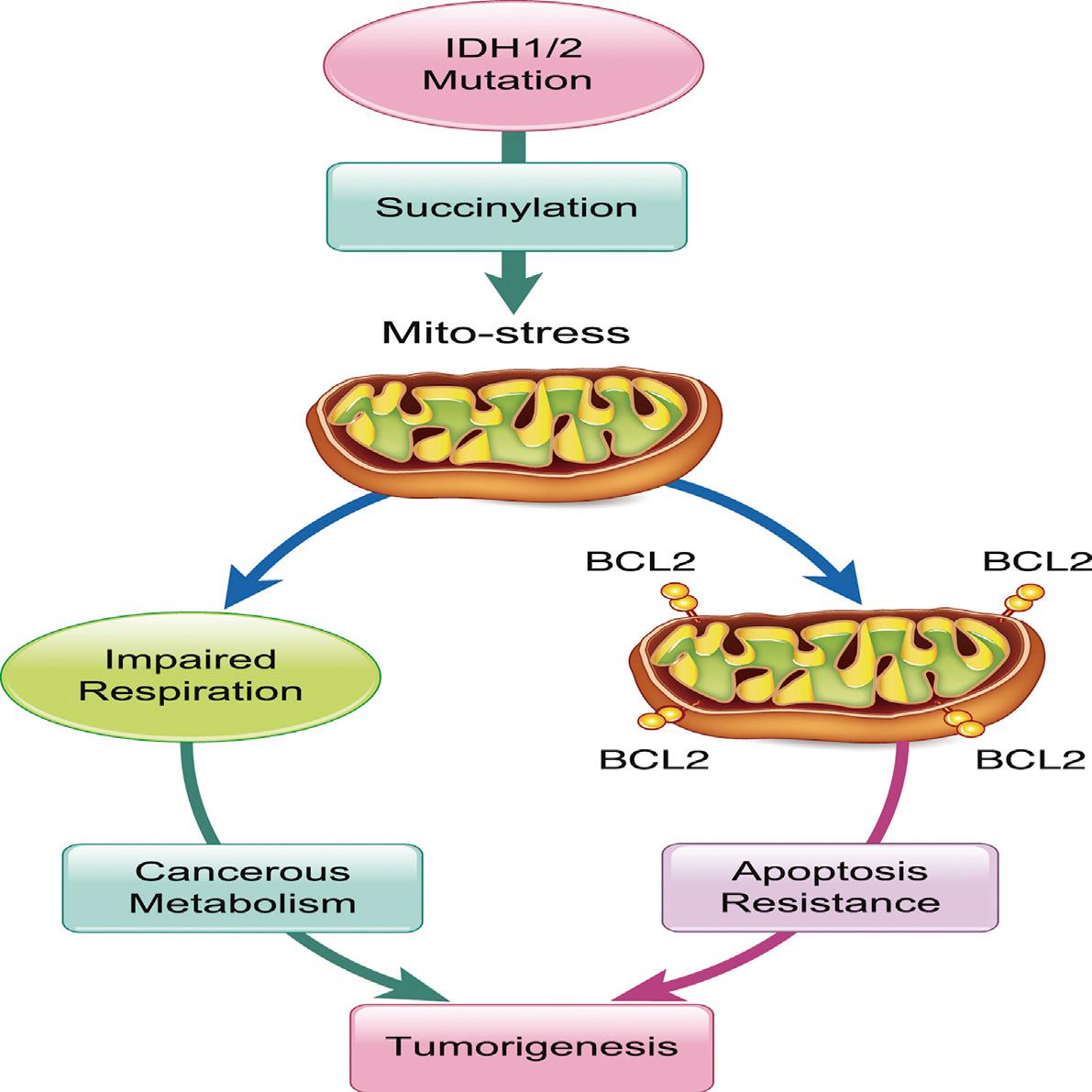
肿瘤代谢物的失调是导致肿瘤发生的重要原因。依赖NADP+的异柠檬酸脱氢酶(NADP+-IDH,包括IDH1和IDH2)突变被发现存在于脑胶质瘤、急性髓性白血病和胆管癌等肿瘤中。前期研究显示,NADP+-IDH通过产生的肿瘤代谢物R-2-hydroxyglutarate(R-2HG),抑制一类以a-KG(a-ketoglutarate)为底物的双加氧酶而发挥其病理作用。其中通过抑制DNA和组蛋白的去甲基化而改变细胞表观遗传性状被认为是主要病理机制。我们认为,R-2HG作为a-KG的结构类似物也应该是succinate及fumarate(同为a-KG结构类似物)的结构类似物,其累积应该产生与琥珀酸脱氢酶Succinate Dehydrogenase(SDH)及富马酸水化酶fumarase(FH)突变类似的促肿瘤效果。通过本研究我们发现,R-2HG竞争性的抑制三羧酸循环中的SDH及FH,累积succinyl-CoA而诱导细胞的高琥珀酰化状态。由于succinyl-CoA在线粒体中产生,R-2HG特别的诱导线粒体高琥珀酰化,抑制线粒体呼吸并促进细胞的代谢转变为肿瘤代谢。同时,高琥珀酰化还诱导抗凋亡因子BCL-2富集于线粒体膜,增强了细胞抵抗凋亡的能力。NADP+-IDH突变的神经胶质瘤和FH突变的肾细胞癌样本中的琥珀酰化水平较野生型样本显著上升。过表达SIRT5降低含有IDH1-R132C突变的HT1080细胞的增殖速度;过表达能代谢succinyl-CoA的血红素合成通路限速酶ALAS1以及添加促进succinyl-CoA代谢的甘氨酸(Glycine)都能降低细胞的琥珀酰化水平并抑制HT1080细胞的增殖以及在小鼠中的成瘤。我们的研究发现诱导细胞高琥珀酰化是NADP+-IDH突变及SDH和FH突变的致癌新机制,SIRT5、ALAS1可以作为干预靶点,甘氨酸可以作为带有相关突变的肿瘤的干预分子。