上个世纪70年代,人们在对定居于格林兰岛的爱斯基摩人(又称因纽特人)进行研究时发现了一个十分有趣的现象:尽管爱斯基摩人饮食中脂肪和胆固醇的摄入量很高,但是他们心血管疾病的发病率却明显低于在丹麦的定居人群,这一现象后来也被称作爱斯基摩悖论。通过对他们的饮食结构进行分析,人们发现爱斯基摩人的传统饮食中富含大量的Omega-3家族的长链多不饱和脂肪酸(n-3 PUFAs),也就是我们现在所熟知的鱼油(主要成分是DHA和EPA)。 自此,鱼油走上了“封神”之路:除了被报道可以降低心血管疾病风险,鱼油还被发现对糖尿病、癌症、阿尔兹海默症在内的多种疾病具有益处。2004年,FDA正式发表公告宣布鱼油是合格的保健食品。另一方面,大量的临床试验和流行病学调查则得出了很多相反的结论。鱼油对于人体的健康究竟有没有益处,直到现在依然存在很大的争议。这其中一个很重要的原因就在于n-3 PUFAs的作用机制一直没有被研究清楚。 2022年3月15日,团队合作中科院大连化物所在Cell Reports上发表了题为Methylene-bridge tryptophan fatty acylation regulates PI3K-AKT signaling and glucose uptake的研究文章,报道多不饱和脂肪酸会修饰蛋白质色氨酸形成一种新的蛋白质酯化修饰,并揭示了DHA和EPA修饰激活PI3K-AKT信号和调控血糖吸收的分子机制。

研究人员发现将PUFAs与蛋白质在体外孵育之后会引起蛋白条带在电泳时发生迁移,提示PUFAs与蛋白之间可能形成了共价结合。在复旦大学化学系侯军利老师的帮助下,解析该反应的具体机制:在自由基的驱动下,PUFAs的亚甲基桥(Methylene-bridge)会与色氨酸残基侧链的C1以C-C单键的方式共价结合,这提示PUFAs可能会形成一种新的蛋白质酯化修饰。
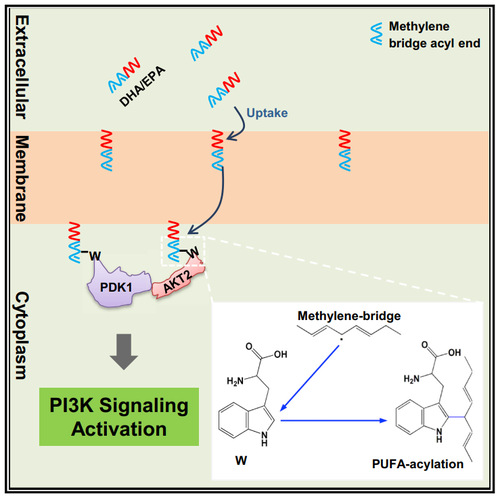
那么PUFA修饰是否可以去解释n-3 PUFAs 复杂的生理功能呢?借助磷酸化蛋白组学,研究人员发现胰岛素信号通路是受PUFA修饰调控的潜在信号通路,并且发现DHA和EPA会通过修饰该通路中的PDK1和AKT2蛋白来直接激活胰岛素通路:首先,外源添加的DHA和EPA会被细胞摄取并整合到细胞膜的磷脂中;接下来,细胞膜中 DHA 和 EPA 会由于磷脂的运动修饰到被PIP3招募至细胞膜附近的PDK1 和 AKT2上。最后,DHA和EPA修饰会促进PDK1和AKT2上膜并激活AKT下游信号。 基于这样的机制,研究人员猜测DHA和EPA对PDK1和AKT2的修饰可能会带来两种生物学效应:一方面,由于PDK1和AKT2同时被促上膜,使得AKT的信号被迅速激活。另一方面,DHA和EPA修饰将细胞内大部分的PDK1和AKT2“锚定”在细胞膜上,使得细胞中能够响应Insulin刺激的PDK1和AKT2减少,阻碍了Insulin信号的传递。在小鼠模型中,研究人员发现DHA和EPA饲喂小鼠具有更强的血糖吸收能力,但是它们对于Insulin的敏感性会降低,并会表现出胰岛素抵抗的特征。因此,这也解释了为什么n-3 PUFAs在2型糖尿病患者中会具有如此复杂的生理效应,不同的服用剂量和试验设定甚至会得出相反的实验结论。总的来说,研究人员认为DHA和EPA的降血糖作用更像是一把“双刃剑”:尽管大量服用DHA和EPA的确可以帮助降低血糖,但它们同样会降低机体自身对于胰岛素的敏感性。 综上,这一工作不仅揭示了一种全新的蛋白质酯化修饰,同时也为目前临床上观察到的n-3 PUFAs 复杂的生理现象提供了可能的机制解释。另外,考虑到棕榈酰化(Palmitoylation)和豆蔻酰化(Myristylation)这两种经典的酯化修饰已经被证明在细胞信号调控中发挥着重要作用,不排除多不饱和脂肪酸修饰也具有同等重要的生理功能。