哺乳动物卵泡作为卵巢组织基本的生殖单位,对于卵巢正常行使功能至关重要。雌性个体出生时具备有限数量的原始卵泡库,随着青春期性成熟,卵泡受到下丘脑GnRH-垂体FSH/LH信号的周期性调控,其内部卵母细胞生长、颗粒细胞增殖,进而发育成各个成熟阶段的卵泡并最终排卵。随着雌性个体生殖周期的不断进行,卵泡不断发育、凋亡、排卵、形成黄体,最终导致有限数量的原始卵泡库耗竭,进而发生卵巢的衰老,人类卵巢自然衰老的年龄大概在51周岁。
卵巢早衰(POI)指的是由于卵巢功能下降,导致女性40岁之前的绝经,其发病率呈现逐年上升。基因、代谢因素与卵巢早衰的发病密切相关,但其中的机制尚未被阐明。2025年4月29日,复旦大学附属妇产科医院徐薇研究员/附属中山医院陈允钦副主任医师合作在Cell Death Discovery杂志发表题为“AARS2-catalyzed lactylation induces follicle development and premature ovarian insufficiency”的研究论文,发现线粒体乳酰化修饰酶AARS2催化的线粒体蛋白PDHA1/CPT2乳酰化会导致卵泡颗粒细胞发生代谢重编程,引起颗粒细胞乳酸和脂肪酸累积,促进卵泡发育和卵巢早衰的发病。
他们发现,卵巢早衰病人血清乳酸和脂肪酸水平升高,并且与卵巢储备能力呈现负相关,提示乳酸和脂肪酸代谢异常可能是卵巢早衰的致病因素。先前有多篇临床研究报道卵巢早衰病人伴随线粒体丙氨酰tRNA合成酶(AARS2)的突变,基于AARS2具有催化乳酰化修饰的能力,研究人员检测了临床上报道的卵巢早衰相关的AARS2高频突变体R199C、F50C、T382K、A77V的乳酰化修饰能力,发现这些突变体的乳酰化修饰能力增强。通过在卵母细胞和颗粒细胞构建AARS2过表达和敲除的小鼠模型,证实颗粒细胞中AARS2过表达导致卵泡发育提早激活,引起卵巢早衰。机制上,AARS2突变或者过表达引起底物PDHA1/CPT2的乳酰化会抑制二者的酶活性,导致线粒体呼吸和脂肪酸氧化过程被抑制,加重颗粒细胞糖酵解代谢物和脂肪酸的累积。糖酵解代谢物通过激活mTORC1信号促进颗粒细胞增殖,脂肪酸激活颗粒细胞PPARγ,增加颗粒细胞对于FSH信号的敏感性,二者共同的作用导致颗粒细胞过度增殖、卵泡发育加速,使得卵巢中有限数量的原始卵泡提早耗竭,发生卵巢早衰(图1)。
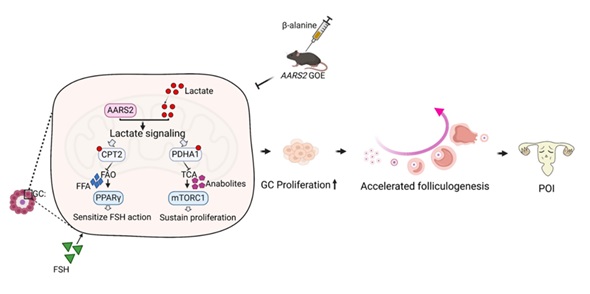
图1 文章模式图
针对这一机制,研究人员提出并证实利用乳酰化修饰的小分子抑制剂β-alanine能够有效缓解小鼠卵巢早衰表型。鉴于β-alanine在运动员群体中作为缓解运动后肌肉疲劳的补充剂被广泛使用,其具有较高的临床转化价值。另外,该研究揭示乳酸信号具有促发育的作用,由于乳酸信号广泛存在于机体的所有组织器官中,这提示我们乳酸可能在其他组织器官的发育中扮演重要的角色。
复旦大学附属妇产科医院/生物医学研究院徐薇研究员和附属中山医院陈允钦副主任医师为论文共同通讯作者,复旦大学生物医学研究院2018级博士研究生张之玲为第一作者。复旦大学代谢与整合生物学研究院赵世民教授,复旦大学生命科学研究院赛音贺西格老师、安艳捧老师以及南京医科大学李朝军教授对该研究提供了大力支持。项目获得国家重点研发计划,国家自然科学基金和深圳市卫计委医疗卫生“三名工程”等多项基金资助。